完结下列化学反响方程式: (1)除掉氯化亚铁溶液中少数的氯化铁 (2)乙炔在催化剂和加热条件下和氢反响制氯乙烯: 3)
日期:2023-02-04 21:11:56 来源:常见问题
【查阅材料】本品为糖衣片,除掉糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO
【试验过程】取本品10片,在恰当的条件下配成100mL溶液,别离精确量取20mL溶液,用下列两种办法进行试验:
办法二:加过量H2O2溶液,然后再参加过量NaOH溶液,得红褐色沉积,将沉积过滤并充沛加热得红棕色固体,称量该固体的质量.
(1)办法一中,制造必定物质的量浓度的酸性高锰酸钾溶液时,所需求的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有容量瓶容量瓶.
(2)办法二中,加过量H2O2溶液的意图是使Fe2+彻底氧化成Fe3+使Fe2+彻底氧化成Fe3+.有的同学以为运用新制氯水也能到达此意图,写出反响的离子方程式2Fe2++Cl2=2Fe3++2Cl-2Fe2++Cl2=2Fe3++2Cl-,和运用新制氯水比较,用H2O2溶液的优点是无污染无污染.
(3)在办法一中,若每耗费1mL酸性高锰酸钾溶液相当于0.152gFeSO4,则该溶液中高锰酸钾的物质的量浓度是0.2mol?L-10.2mol?L-1.
在办法二中,若称得红棕色固体的质量为ag,则每片补血剂含FeSO40.95a0.95ag.
的办法是________________________________。
等大气污染物,若将二者依照必定份额通入水中可削减或消除污染。试规划简略试验查验二者是否刚好彻底反响。(扼要描绘试验过程、现象和定论)
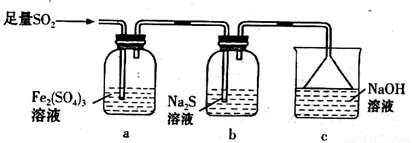
试验I:向第一份溶液中参加足量的NaOH溶液,生成白色沉积,敏捷变为灰绿色,终究变为红褐色
的办法是________________________________。
等大气污染物,若将二者依照必定份额通入水中可削减或消除污染。试规划简略试验查验二者是否刚好彻底反响。(扼要描绘试验过程、现象和定论)

试验I:向第一份溶液中参加足量的NaOH溶液,生成白色沉积,敏捷变为灰绿色,终究变为红褐色
(15分)S2Cl2常用于橡胶硫化、有机物氯化的试剂,试验室可利用如下设备来制备S2Cl2。(部分夹持仪器已省略)
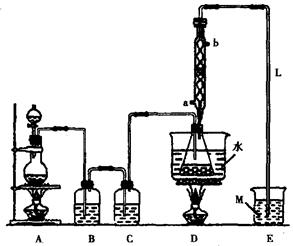
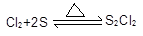
(1)A部分仪器安装时,放好铁架台之后,应先固定(填仪器称号)。整套设备安装结束后,应先进行,再增加试剂,冷凝水进水口是(填“a”或“b”)。试验结束,A中不再发生氯气时,可撤除设备,撤除时,最早进行的操作应是。
(2)S2Cl2分子中各原子均到达8电子安稳结构,写出其电子式;用化学方程式表明撤去C设备的结果;用直接加热替代水浴加热的结果是。
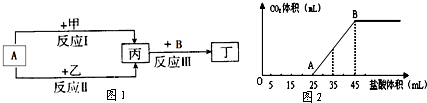
(1)反响I中,甲在一般条件下和A剧烈反响,除丙外,还生成一种焰色反响为黄色的物质,则工业上出产甲的一般办法是.
(2)反响Ⅱ中,乙与A在高温下反响,除丙外,还生成一种有磁性的物质,则反响Ⅱ的化学方程式是.
(3)经过比较反响I、Ⅱ的反响条件,可得出甲的金属性比乙的金属性强弱联系,比较二者金属性强弱的根据还可所以(写出一种即可).
(4)将3.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物彻底溶解于水,制成稀溶液,然后向该溶液中逐滴参加1mol?L-1的盐酸,所参加盐酸的体积与发生CO2的体积(标准状况)联系如图2所示.
(5)若甲、乙是化合物,反响Ⅲ是工业制漂白液的反响.其间乙为含有非极性键的离子化合物,若向氯化亚铁溶液中参加固体乙,发生红褐色沉积,但无气体生成,该反响的离子方程式为.

 0755-86110165
0755-86110165




