下列表明正确的是
日期:2024-01-18 01:38:37 来源:常见问题
解:A.氯化氢为共价化合物,氯原子最外层到达8个电子安稳结构,氯化氢的电子式为
B.质子数为6,中子数为8的核素,为碳元素,质量数为14,可表明为${\;}_{6}^{14}$C,故B正确;

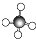
点评本题归纳考察化学用语,为高频考点,触及电子式、离子结构示意图、球棍模型及结构简式等常识,难度不大,留意把握电子式、分子式、结构简式、结构式的概念及差异,清晰球棍模型与份额模型的表明办法.
(4)化合物B有多种同分异构体,其间只含有一种官能团的同分异构体有6种;假如这种同分异构体能与NaHCO
(1)因为电石、金属钠、金属钾等物质可以跟水反响给灾后救援作业带来了许多困难.
②电石的首要成分为CaC2,遇水会发生可燃性气体,写出CaC2中所含的化学键类型离子键和共价键
(3)事端发生后,爆破中心区、爆破区居民楼周边以及海河等处都受到了严峻的氰化物污染.处理NaCN的办法有多种.
办法二:用氯气处理CN-是选修一上介绍的一种办法,可谓以毒攻毒,请写出碱性条件下用氯气氧化CN-生成可溶性碳酸盐和一种空气中首要气体的离子反响方程式5Cl2+12OH-+2CN-=10Cl-+2CO32-+6H2O+N2↑.
办法三:这些走漏的将经过喷洒双氧水的办法来处理,用双氧水处理后会开释氨气一起生成无毒的碳酸氢钠,以减轻污染.写出离子反响方程式CN-+H2O+H2O2═NH3+HCO3-.
(4)环保部门为测定H2O2溶液浓度,办法如下:用移液管汲取10.00mL的H2O2样品盛入l00ml容量瓶中,加水稀释至刻度线mL溶液盛入锥形瓶里,再参加l0mL3mol/L稀硫酸(过量),用0.02mol/L的规范浓度的KMnO4溶液滴定,所用体积为20.00ml,滴定至结尾时,溶液色彩的改变溶液由无色变为浅赤色或赤色;原H2O2溶液的浓度为0.4mol/L.
A、B的物质的量浓度之比为3:5,C的均匀反响速率是0.1mol/(Lmin),求:
(1)此刻A的物质的量浓度是0.75mol/L反响开端前容器中的A、B的物质的量:n(A)=n(B)=3mol
(4)若改用3L的密闭容器,盛放与上述相同量的A、B气体,则到达平衡后,A和B的物质的量浓度的比值=3:5(填“>”“=”“<”).

 0755-86110165
0755-86110165




